索菲恩生物科技(上海)有限公司
2 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
推荐产品
公司新闻/正文
使用8通道自动膜片钳QPatch Compact对hiPSC诱导的神经元细胞进行检测
3944 人阅读发布时间:2025-09-24 19:17
摘要
本研究采用BrainXell提供的人源诱导多能干细胞(hiPSC)分化的神经元(包括大脑皮层谷氨酸能神经元和脊髓运动神经元),在8通道自动膜片钳QPatch Compact(以下简称QPC)平台上进行了配体门控通道电流、电压门控通道电流以及动作电位进行记录。全细胞记录成功率高可达60%。
实验结果
典型的单细胞NaV电流、KV电流、AMPA电流以及动作电位如图1-4所示。
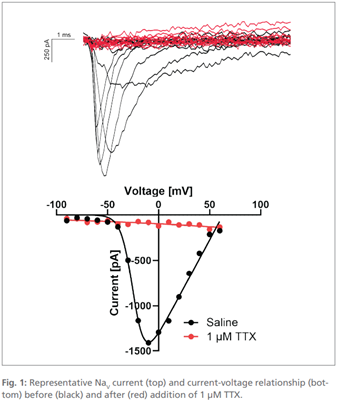
图1:在加入1µM河.豚毒素(TTX)前(黑色曲线)与加入后(红色曲线)的典型NaV电流(上图)及其电流-电压关系(下图)。
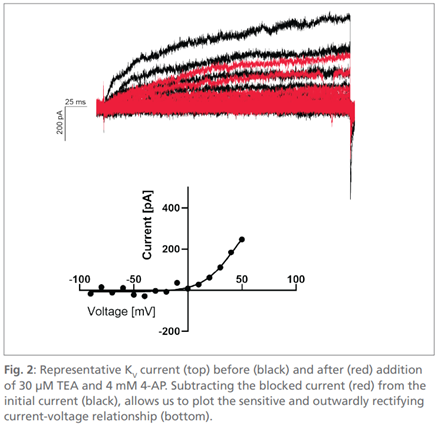
图2:在加入30µM四乙铵(TEA)与4mM 4-氨.基吡啶(4-AP)前(黑色曲线)与加入后(红色曲线)的典型KV电流(上图)。通过将受阻电流(红色)从初始电流(黑色)中相减,可以绘制出对阻滞剂敏感且具有外向整流特性的电流-电压关系(下图)。
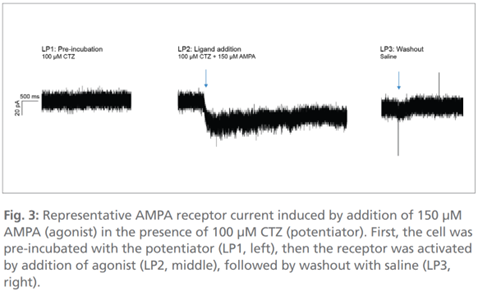
图3:在加入100µM CTZ(增强剂)的条件下,加入150µM AMPA(激动剂)所诱导的典型AMPA受体电流。实验流程为:首先用增强剂预孵育细胞(LP1,左图),随后通过加入激动剂激活受体(LP2,中图),最后用生理盐水冲洗(LP3,右图)。
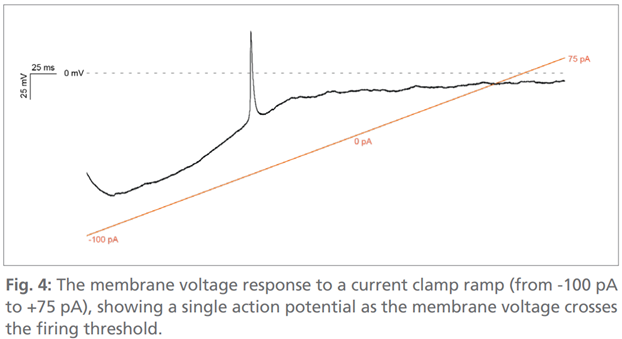
图4:在电流钳斜坡刺激(从-100pA到+75pA)的条件下,膜电位的变化过程。可以看到,当膜电位跨越放电阈值时,神经元产生了一个动作电位。
讨论
如预期那样,NaV电流在加入1µM河.豚毒素(TTX)后被完全阻断(图1)。而KV电流在加入30mM四乙铵(TEA)和4mM 4-氨.基吡啶(4-AP)后仅部分受阻,剩余的电流可能来源于漏电流,或由其他阴离子(如F⁻或Cl⁻)介导的电流(图2,上图)。通过将受阻电流(红色曲线)从原始电流(黑色曲线)中相减,可以得到对阻滞剂敏感并表现出外向整流特性的电流-电压关系(图2,下图)。
AMPA受体的激活则通过在100µM环噻嗪(CTZ,增强剂)存在的条件下加入150µM AMPA(激动剂)实现,随后用细胞外液进行洗脱,电流消失(图3)。最后,我们在电流钳斜坡刺激(从-100pA到+75pA)的条件下成功记录到单个动作电位。当膜电位达到约-50mV的阈值电位时,神经元触发放电(图4)。
在使用QPC对hiPSC诱导的神经元进行实验时,关键步骤是将神经元网络系统分离为纯净且存活良好的单细胞悬液。
对于更高级的应用,自动化膜片钳(APC)结合hiPSC神经元可用于疾病表型的检测以及动作电位的测量。